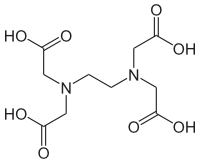
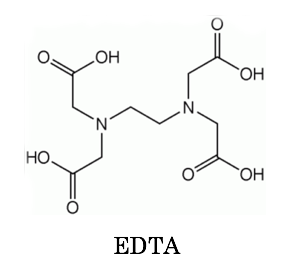
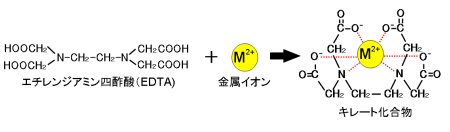
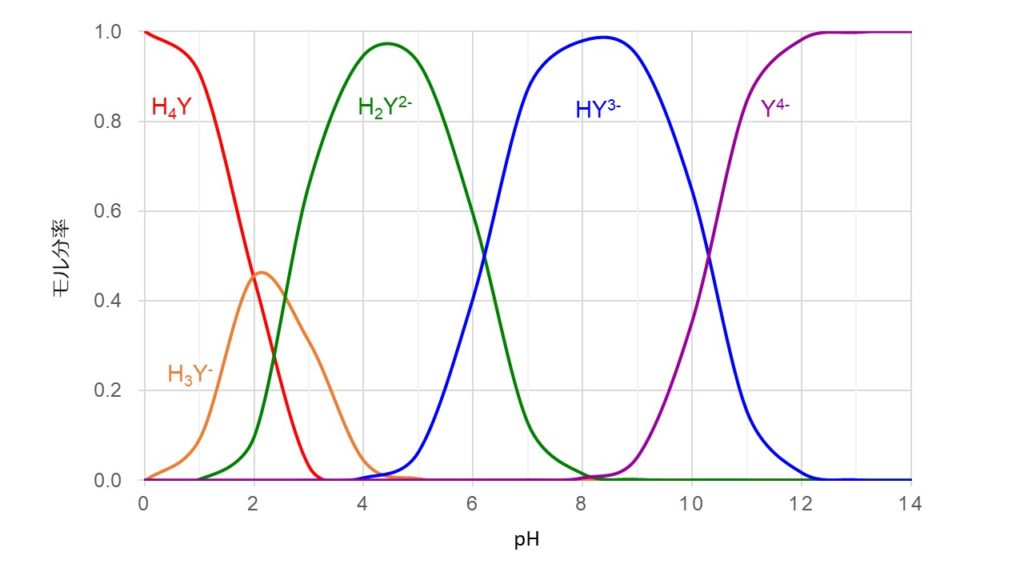
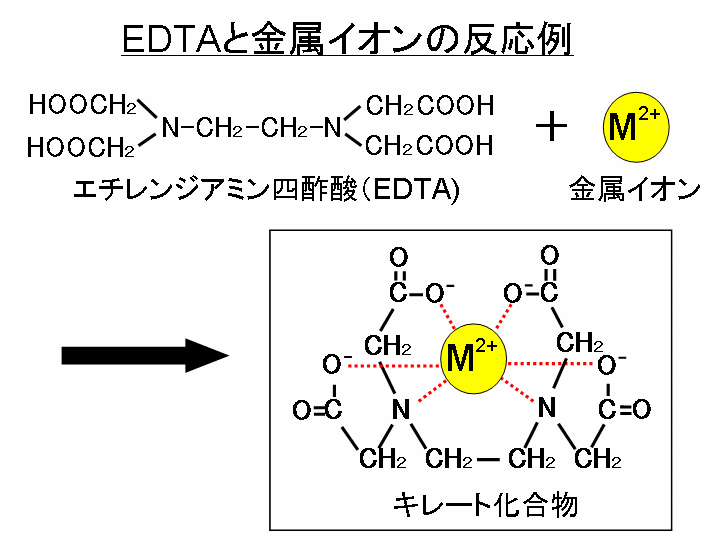
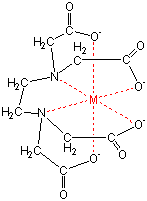
キレート滴定 濃度既知のca 0005m ca2溶液による水道水、ミネラルウォーターの硬度決定 実験日 5月9日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:快晴 気温:8℃ 湿度:28% 目的 キレート滴定(edta法)により、edta溶液の濃度を決定し、edta法を用いて水道水、ミネラルト滴定法は,エチレンジアミン四酢酸 (EDTA)及びその類縁体が,多くの金属イオンと価数に依らず1:1のキレート錯体 を形成することを利用した金属イオンの容量分析法である。 この方法は,主にCa2 +及びMg2+の滴定法(水の硬度の測定)として知 られさているが,適当な条件と金属指示薬の使用によって多くの金属イオンのmg/Lレベ ルでの定量が可能であるキレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ( ) pH = 57の場合、分子形:イオン形 =1:10である。 ( ) pH = 47の場合、分子形分率は50 %である。
カルシウムキレート剤 脳科学辞典
キレート滴定 ph 理由
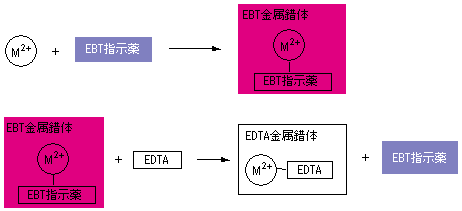
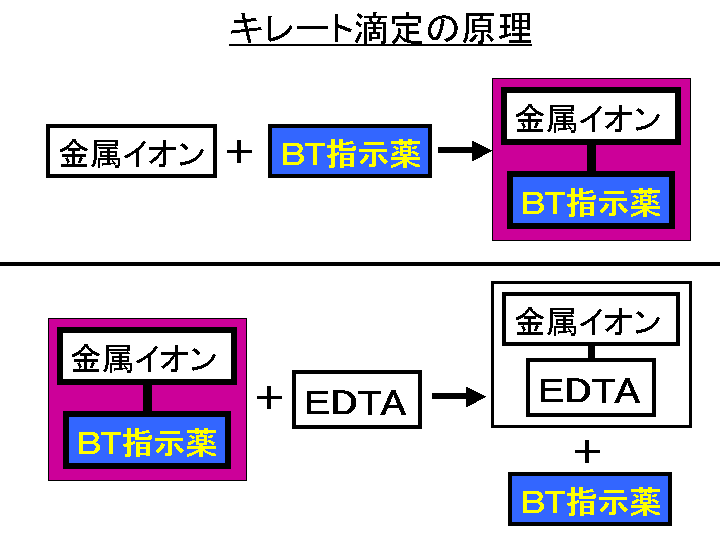
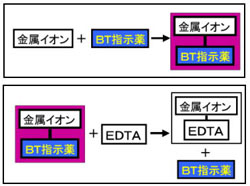
キレート滴定 ph 理由-そこで、滴定の終点を見えるようにするため、 ebt(エリオクロムブラックt) などの指示薬を使用します。ebtを指示薬とした場合、 赤 → 青 となった時点を終点とできます ebtもキレート剤として働き、ca、mgなどと錯体を形成した際、赤色を示します。従ってこのような特殊なキレート試薬は適当に利用すれば、混合イオンの選択滴定に大いに役立つと思われる。 参考文献 1) 上野景平,"キレート滴定法", 南江堂 2) F S Sadek,R W Schmid and C N Reilley, Talanta, 1959, 2, 38 3) E Wanninen, Talanta, 1961, 8, 355



滴定 とは 意味 エキサイト辞書
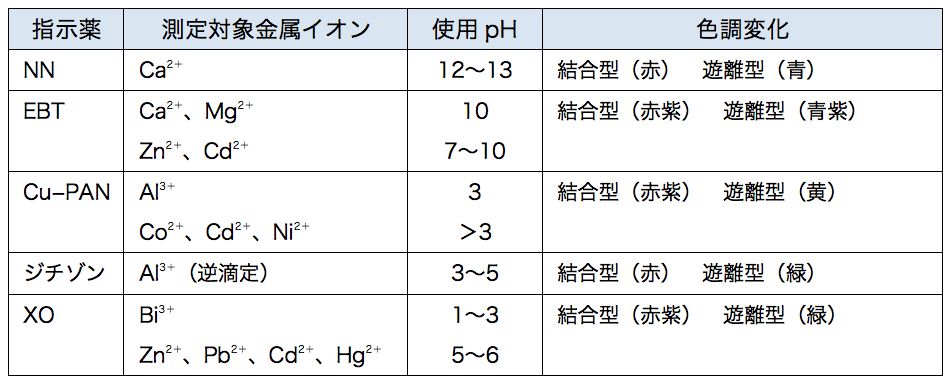
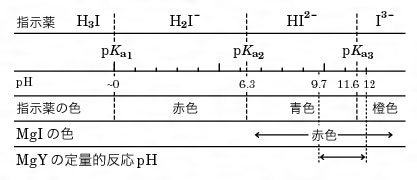
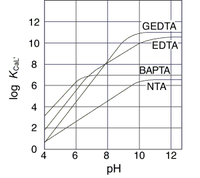
Ca2+,Mg2+のキレート滴定における金属指示薬とpHの関係は次のとおりである。 Ca2+ とMg2+ はpH 10でEBTを指示薬として同時に滴定される。しかし,EDTAで Ca2+ のみを直接滴定する場合,Ca2+ EBT錯体の生成定数*)が小さく(当量点のpMと指ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。キレート滴定に用いられる主な金属指示薬を以下に示す。 金属指示薬については、目的金属イオンとEDTAとのキレート形成に最適なpHで変色する指示薬を選択する必要がある。 3 医薬品の定量 <例:塩化カルシウム水和物(CaCl 2 ・2H 2 O:)の定量>
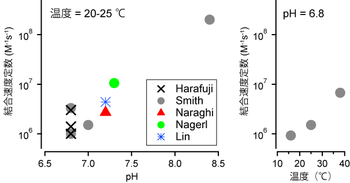
33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定に138 ∴pH =78 よって、 (1)の結果と合わせると、 Cd 2のキレート滴定の 至適 pH 範囲 は、 40 <pH <78 となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる!キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ( ) pH = 57の場合、分子形:イオン形 =1:10である。 ( ) pH = 47の場合、分子形分率は50 %である。
金属イオンの滴定法をキレート滴定法と呼ぶのもそのた めです 3 滴定試薬としての応用(キ レート滴定法) 3・1 キレート滴定法の原理 ふたたび反応式(iii)に ついて考えてみましょう あ る金属イオン(m)の 水溶液にedta溶 液(y)を 滴PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。レート滴定法の原理,そこで用い られる応用的な手法(逆滴定,置換滴定,マ スキングなど)につい て概説するとともに,これを用 い たい くつ かの金属イオンの定量法を紹介する。 1 は じめ に キレート滴定は,G, Schwarzenbach(シュ ヴァ ルツ ェ



カルシウムキレート剤 脳科学辞典


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
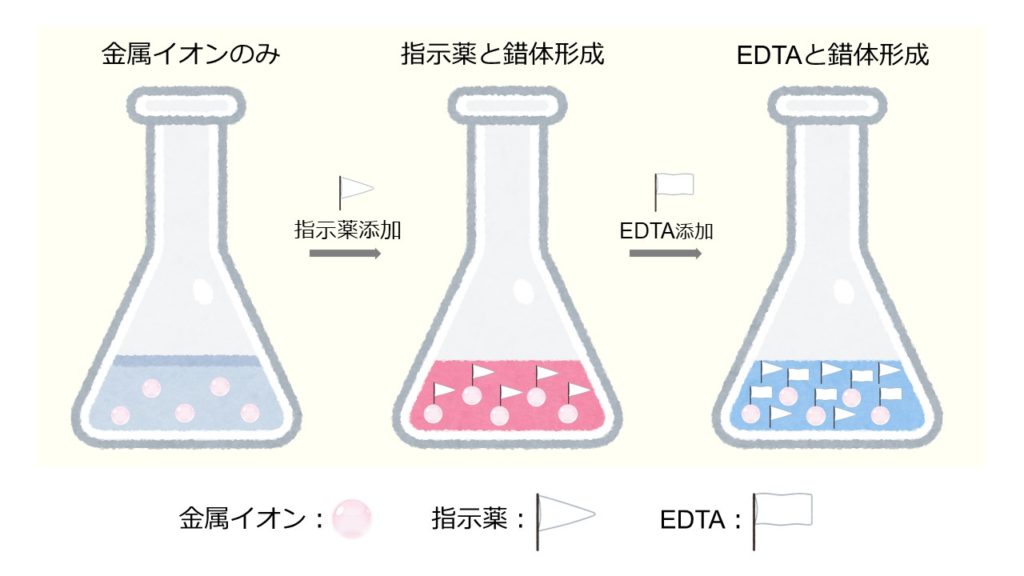
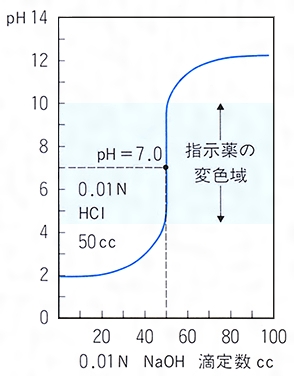
中和滴定曲線 この章では中和滴定曲線について解説していきます。 中和滴定曲線って? まず、この図を見てください。 これは、酸に塩基を少しずつ加えていった時のpHの変化を表したグラフです。 途中で凄い勢いでpHが上昇している部分があるのががって,キ レート滴定の選択性を高めるためには,い ろ いろの手段が講ぜられているが,そ のおもなものをあげ れば, (1) EDTAを 滴定試薬として用いる場合 a pHの 調節による選択性の向上 b 選択的いんぺい剤の応用 (2) EDTA以 外の選択的滴定試薬を用いる。②6 mL/L KOH溶液4 mL(pH=12ではマグネシウムは水酸化物Mg(OH)2になり、キレートを生成しない。)を加えてよく振り混ぜ、1分間放置する。 ③NN指示薬01 gを加え、EDTA標準溶液でNN指示薬の赤色が青色となり、赤みがなくなった時が終点である。3回の滴定の平均をとる。


キレート滴定のedat溶液の標定においてアンモニア緩衝液を使用した Yahoo 知恵袋


キレート滴定 Edtaによる水の硬度測定 薬剤師が教える健康情報ブログ
キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化物となってEDTAと反応しなくなるので、このpH領域で作用するNN指示薬を用いて Ca 2+ のみを定量することができる。滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2CuPANをもちいる直接滴定においても同様の効果が得られる。 ・Cu 2 はpH25~10の範囲で滴定することができるが、低いpHで滴定するほど共存イオンの影響は 少なくなる。たとえばpH4~5で滴定すればアルカリ土類金属イオンおよび少量のMn 2 は影響せず、



滴定 とは 意味 エキサイト辞書


カルシウムキレート剤 脳科学辞典
滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch22.キレート効果 (text p) 二座以上の配位子が金属イオンを挟むような形で錯体を形成するとき,中心金属と配位原子を含む環 ができる.このような錯体をキレート(金属キレートあるいはキレート化合物)とよぶ.<化学>キレート滴定関連で質問です。 滴下する溶液に、kohを加えるのですが、phを高くする為に使用する。という事ですが、どんな作用で何でその必要があるんですか? また遮蔽剤とは何のことでしょう? 化学的理


キレート滴定 Yakugaku Lab



無料印刷可能 酸化 還元 滴定 考察 画像ブログ
②6 mL/L KOH溶液4 mL(pH=12ではマグネシウムは水酸化物Mg(OH)2になり、キレートを生成しない。)を加えてよく振り混ぜ、1分間放置する。 ③NN指示薬01 gを加え、EDTA標準溶液でNN指示薬の赤色が青色となり、赤みがなくなった時が終点である。3回の滴定の平均をとる。化学 何故edta標準溶液は001mなのか? キレート滴定をやったのですが何故edta標準溶液は001mのものを使うのか理由がわかりません。多すぎるとphなどに影響が出るからでしょうか?分かる 質問noキレート滴定に用いられる主な金属指示薬を以下に示す。 金属指示薬については、目的金属イオンとEDTAとのキレート形成に最適なpHで変色する指示薬を選択する必要がある。 3 医薬品の定量 <例:塩化カルシウム水和物(CaCl 2 ・2H 2 O:)の定量>


キレート滴定とは コトバンク


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋
4.キレート滴定 41 001Medta標準溶液の調製 要点 キレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム 塩h2na2y・2h2oでetaと表示されている。この試薬は結晶水以外に多少の水分を含んでキレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。EDTAを加えるとキレート効果で置換されるためNN、BTは遊離して青を示す。 高pH条件ではMgが水酸化物沈殿を生じるため、pHの変化のみで定量が可能。 (3) トリエタノールアミンを加えた理由 EDTAとの錯生成に干渉する金属イオンのマスキング(特にAlやFe)


キレート滴定 Yakugaku Lab


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
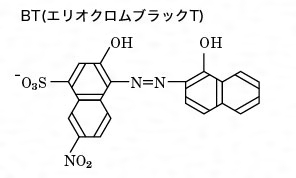
キレート試薬が酸であるため、pHの影響が大きい。 (M)n+Hm (Y)m4⇔M (Y)n4+mH の平衡で水素イオン濃度が高いと左に偏り、キレート生成反応が進行しない。�キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。


水の硬度測定 キレート滴定


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



当量点の求め方 滴定曲線からの当量点の求め方がよく分かりません 化学 教えて Goo


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋


キレート滴定のレポートでキレート滴定では緩衝液を加え液のphを一定に保つ Yahoo 知恵袋


滴定とは コトバンク


水の硬度測定


Water Quality


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



無料印刷可能 酸化 還元 滴定 考察 画像ブログ


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com



キレート滴定 Yakugaku Lab


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


化学 中和滴定 技術情報館 Sekigin 酸塩基滴定 中和滴定 の概要紹介 滴定曲線 滴定の基本操作 基本用語について紹介



なぜzn2 ではなくfe2 が沈殿したのでしょうか アンモニア水で沈殿す 化学 教えて Goo


Column



分析化学2 Flashcards Quizlet



比色試薬 金属指示薬 Bt 同仁化学研究所


キレート滴定とは コトバンク



無料印刷可能 酸化 還元 滴定 考察 画像ブログ


キレート滴定行ったのですが 緩衝溶液を入れる理由が分かりません Phの変化 Yahoo 知恵袋


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋


水の分析


すぐできる なるほど ザ 化学実験室 日本分析化学専門学校


水の硬度測定 キレート滴定


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋


比色試薬 金属指示薬 Xo 同仁化学研究所


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


水の硬度測定 キレート滴定



重金属を含んだ排水の処理方法 水処理に関するご相談は 栗田工業


水の硬度測定



エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com


カルシウムキレート剤 脳科学辞典



中和滴定 Yakugaku Lab


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


水の硬度測定 キレート滴定


質問箱



分析化学2 Flashcards Quizlet


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋



第11章 金属錯体



京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube



もくじ Ph Phとは Phの測定原理 校正と測定 電極のメンテナンス サンプルに適した電極選択 16 Horiba Ltd All Rights Reserved 2 Pdf Free Download



分析化学i 京大の過去問を淡々とうpするblog



0 件のコメント:
コメントを投稿